Utilidades en la industria de los alcoholes, éteres y esteres
Creado por: Maya Brissett Suarez Galvis
grado: 11-3t
ALCOHOLES
En química se denomina alcohol a aquellos compuestos químicos orgánicos que contienen un grupo hidroxilo (-OH) en sustitución de un átomo de hidrógeno enlazado de forma covalente a un átomo de carbono. Además, este carbono debe estar saturado, es decir, debe tener solo enlaces simples a sendos átomos,1 esto diferencia a los alcoholes de los fenoles.
Si contienen varios grupos hidroxilos se denominan polialcoholes. Los alcoholes pueden ser primarios, secundarios o terciarios, en función del número de átomos de hidrógeno sustituidos en el átomo de carbono al que se encuentran enlazado el grupo hidroxilo.
Que son ?
los alcoholes son compuestos orgánicos formados a partir de hidrocarburos saturados o insaturados, mediante la sustitucion de uno o varios hidrógenos por uno o varios grupos hidroxilo (oh) cuyo grupo funcional representa a los alcoholes. estan formados principalmente por carbono, hidrógeno y oxigeno
Como se nombran?
los alcoholes se nombran de la misma manera que los hidrocarburos de los cuales proceden cambiando la terminación por "ol" del alcohol, e indicando el carbono localizador donde se hizo la sustitucipon del hidrógeno por el oh, segun la posición del carbono donde esta el oh, los alcoholes pueden ser primarios, secundarios y terciario.
cuando los alcoholes son ciclicos no hay que olvidar anteponer la palabra "ciclo" al nombre del hidrocarburo tomando como carbono numero 1 donde esta el oh
CH3-CH-OH etanol
CH3-CHOH-CH3 2-propanol
CH2OH-CH2-CH=CH2 3-buten-1-ol
CH2OH-CHOH-CH2OH
propanotriol (glicerol ou glicerina)
Usos
Los alcoholes se utilizan como productos químicos intermedios disolventes en las industrias de textiles, colorantes, productosquímicos, detergentes, perfumes, alimentos, bebidas, cosméticos,pinturas y barnices.
algunos compuestos se utilizan también en la desnaturalización del alcohol, en productos de limpieza, aceites y tintas de secado rápido, anticongelantes.
algunos compuestos se utilizan también en la desnaturalización del alcohol, en productos de limpieza, aceites y tintas de secado rápido, anticongelantes.
Riesgos para la salud, de algunos alcoholes
Metanol:
Se obtiene por la distilacion de la madera, se utiliza en barnices, es muy toxico, puede causar ceguera y hasta la muerte si es ingerido.
Etanol:
Es un liquido inflamable,que se utiliza en infinidad de productos,de limpieza.como disolvente,industria textil, perfumes, alimentos y bebidas
se puede obtener por la destilacion de la fermentacion previam de algunos granos, frutas o verduras.
el peligro en la ingestion se debera al grado de alcohol que contenga, pues puede causar lesiones en el sistema digestivo.
el etanol puede afectar al sistema nervioso central,provocando estados de euforia, desinhibición, mareos, somnolencia, confusión, ilusiones (como ver doble o que todo se mueve de forma espontánea). al mismo tiempo, baja los reflejos. con concentraciones más altas ralentiza los movimientos, impide la coordinación correcta de los miembros, pérdida temporal de la visión, etc. en ciertos casos se produce un incremento en la irritabilidad del sujeto intoxicado como también en la agresividad; en otra cierta cantidad de individuos se ve afectada la zona que controla los impulsos, volviéndose impulsivamente descontrolados y frenéticos. finalmente, conduce al coma y puede provocar muerte.

Clases de alcoholes
Alcohol primario:
Los alcoholes son primarios si el átomo de hidrógeno (H) sustituido por el grupo hidroxilo (-OH) pertenece a un carbón (C) primario, esta clase de alcoholes reaccionan muy lentamente ya que como no tienen la capacidad de formar carbocationes, el alcohol primario activado permanece en solución hasta que es atacado por el ion cloruro pueden tardarse en reaccionar desde 30 minutos hasta varios días.
Alcohol secundario: Un alcohol es secundario, si el átomo de hidrógeno (H) sustituido por el grupo hidroxilo (-OH) , pertenece a un carbón (C) secundario, este tipo de alcoholes se tardan menos en reaccionar de entre 5 y 20 minutos, por que los carbocationes son menos estables que los terciarios
Alcohol terciario: El alcohol se considera terciario si el átomo de hidrógeno (H) sustituido por el grupo hidroxilo (-OH) pertenece a un carbón (C) terciario, estos reaccionan casi instantáneamente, debido a que forman carbocationes terciarios relativamente estables.
Los alcoholes primarios y secundarios cuando se calientan en contacto con ciertos catalizadores, pierden átomos de hidrógeno para formar aldehídos o cetonas.
Si esta deshidrogenación se realiza en presencia de aire (O) el hidrógeno sobrante se combina con el oxígeno para dar agua.
Y a su vez los alcoholes se pueden clasificar según el numero de grupos hidroxilos que contenga el compuesto:
Monoalcohol o Monol: Son alcoholes que tienes un solo grupo hidroxilo (-OH) y son aquellos que pueden clasificarse como alcoholes primarios, secundarios y terciarios
Polialcoholes: Son compuestos que tienen dos o mas grupos hidroxilos (-OH)
Propiedades de los alcoholes
Propiedades físicas
Las propiedades físicas de un alcohol se basan principalmente en su estructura. El alcohol esta compuesto por un alcano y agua. Contiene un grupo hidrofóbico (sin afinidad por el agua) del tipo de un alcano, y un grupo hidroxilo que es hidrófilo (con afinidad por el agua), similar al agua. De estas dos unidades estructurales, el grupo –OH da a los alcoholes sus propiedades físicas características, y el alquilo es el que las modifica, dependiendo de su tamaño y forma.
El grupo –OH es muy polar y, lo que es más importante, es capaz de establecer puentes de hidrógeno: con sus moléculas compañeras o con otras moléculas neutras.

Solubilidad:
Puentes de hidrógeno: La formación de puentes de hidrógeno permite la asociación entre las moléculas de alcohol. Los puentes de hidrógeno se forman cuando los oxígenos unidos al hidrógeno en los alcoholes forman uniones entre sus moléculas y las del agua. Esto explica la solubilidad del metanol, etanol, 1-propanol, 2-propanol y 2 metil-2-propanol.

alcohol-alcohol
alcohol-agua
1 propanol
Hexanol
Existen alcoholes de cuatro átomos de carbono que son solubles en agua, debido a la disposición espacial de la molécula. Se trata de moléculas simétricas

2-metil-2-propanol
Existen alcoholes con múltiples moléculas de OH (polihidroxilados) que poseen mayor superficie para formar puentes de hidrógeno, lo que permiten que sean bastante solubles en agua.

1,2,3 propanotriol (glicerina)
Punto de Ebullición:
Los puntos de ebullición de los alcoholes también son influenciados por la polaridad del compuesto y la cantidad de puentes de hidrógeno. Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones.
El punto de fusión aumenta a medida que aumenta la cantidad de carbonos.
Densidad:
La densidad de los alcoholes aumenta con el número de carbonos y sus ramificaciones. Es así que los alcoholes alifáticos son menos densos que el agua mientras que los alcoholes aromáticos y los alcoholes con múltiples moléculas de –OH, denominados polioles, son más densos.
| Nombre | Punto de fusiónºC | Punto de ebullición ºC | Densidad |
| Metanol | -97,5 | 64,5 | 0,793 |
| 1-propanol | -126 | 97,8 | 0,804 |
| 2-propanol | -86 | 82,3 | 0,789 |
| 1-butanol | -90 | 117 | 0,810 |
| 2-butanol | -114 | 99,5 | 0,806 |
| 2-metil-1-propanol | -108 | 107,3 | 0,802 |
| 2-metil-2-propanol | 25,5 | 82,8 | 0,789 |
| 1-pentanol | -78,5 | 138 | 0,817 |
| Ciclohexanol | 24 | 161,5 | 0,962 |



Propiedades químicas
Los alcoholes pueden comportarse como ácidos o bases, esto gracias al efecto inductivo, que no es más que el efecto que ejerce la molécula de –OH como sustituyente sobre los carbonos adyacentes. Gracias a este efecto se establece un dipolo.
La estructura del alcohol está relacionada con su acidez. Los alcoholes, según su estructura pueden clasificarse como metanol, el cual presenta un sólo carbono, alcoholes primarios, secundarios y terciarios que presentan dos o más moléculas de carbono.| Alcohol Terciario | 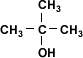 | 2-metil-2-propanol |
| Alcohol Secundario | 2-butanol | |
| Alcohol Primario | 1-butanol | |
| Metanol |
Metanol > alcohol primario > alcohol secundario > alcohol terciario(>: mayor acidez)
Debido a que en el metanol y en los alcoholes primarios el hidrógeno está menos firmemente unido al oxígeno, la salida de los protones de la molécula es más fácil por lo que la acidez será mayor en el metanol y el alcohol primario.
Deshidratación:
La deshidratación de los alcoholes se considera una reacción de eliminación, donde el alcohol pierde su grupo –OH para dar origen a un alqueno. Aquí se pone de manifiesto el carácter básico de los alcoholes. La reacción ocurre en presencia de ácido sulfúrico (H2SO4) en presencia de calor.


La deshidratación es posible ya que el alcohol acepta un protón del ácido, para formar el alcohol protonado o ión alquil hidronio.
El alcohol protonado pierde una molécula de agua y forma un ión alquil-carbonio:


El ión alquil-carbonio pierde un protón lo que regenera la molécula de ácido sulfúrico y se establece el doble enlace de la molécula a la cual está dando origen el alcohol.
El calentamiento de un alcohol en presencia de ácido sulfúrico a temperaturas inferiores a las necesarias para obtener alquenos producirá otros compuestos como éteres y ésteres.
Obtención de alcoholes:
Al igual que a partir de los alcoholes se pueden obtener otros compuestos, los alcoholes pueden ser obtenidos a partir de hidratación o hidroboración – oxidación de alquenos, o mediante hidrólisis de halogenuros de alquilo. Para la obtención de alcoholes por hidratación de alquenos se utiliza el ácido sulfúrico y el calor.


La hidroboración:
(adición de borano R3B) de alqueno en presencia de peróxido de hidrógeno (H2O2) en medio alcalino da origen a un alcohol.


La hidrólisis:
De halogenuros de alquilo o aralquilo se produce en presencia de agua y hidróxidos fuertes que reaccionan para formar alcoholes.
En la industria la producción de alcoholes se realiza a través de diversas reacciones como las ya mencionadas, sin embargo se busca que éstas sean rentables para proporcionar la máxima cantidad de producto al menor costo. Entre las técnicas utilizadas por la industria para la producción de alcoholes se encuentra la fermentación donde la producción de ácido butírico a partir de compuestos azucarados por acción de bacterias como el Clostridium butycum dan origen al butanol e isopropanol. Para la producción de alcoholes superiores en la industria la fermentación permite la producción de alcoholes isoamílico, isobutílico y n-propílico a partir de aminoácidos. Es así como la industria utiliza los procesos metabólicos de ciertas bacterias para producir alcoholes.
Usos de el alcohol
EL METANOL: Es muy toxico, su ingestión puede causar ceguera y hasta la muerte. Es un combustible de alto rendimiento por lo que se lo usa como combustible de autos de carreras.Pero como combustible es menos conocido que el etanol debido a sus altos costos.
EL ETANOL: Es un líquido muy volátil y constituye la materia prima de numerosas industrias de licores,perfumes,cosmèticos y jarabes .También se usa como combustible y desinfectante .
EL PROPANOL: Se utiliza como un antiséptico aún más eficaz que el alcohol etílico; su uso mas común es en forma de quita esmalte oremovedor .Disolvente para lacas, resinas, revestimientos y ceras. También para la fabricación de líquido de frenos, ácidopropiónico y plastificadores.
riesgos que traen los alcoholes para la salud
Metanol
Entre los muchos procesos de síntesis que existen para la producción de alcohol metílico se encuentra la reacción de Fischer- Tropsch entre el monóxido de carbono y el hidrógeno, de la que se obtiene metanol como subproducto. También se produce mediante la oxidación directa de hidrocarburos o mediante un proceso de hidrogenación en dos etapas en el que se hidrogena el monóxido de carbono para dar formiato de metilo, que a su vez se hidrogena para obtener alcohol metílico. Sin embargo, la síntesis más importante es la realizada mediante hidrogenación catalítica a presión del monóxido de carbono o del dióxido de carbono, a presiones de 100-600 kgf/cm2 y temperaturas de 250-400 ºC.
El alcohol metílico tiene propiedades tóxicas que pueden hacerse evidentes tanto por exposición aguda como crónica. Los alcohólicos que ingieren este líquido o los trabajadores que inhalan sus vapores pueden sufrir lesiones. En experimentos con animales se ha demostrado que el alcohol metílico puede penetrar en la piel en cantidad suficiente como para causar una into- xicación mortal.
En casos de intoxicación grave, generalmente por ingestión, el alcohol metílico actúa de forma específica en el nervio óptico causando ceguera como resultado de la degeneración del nervio óptico, acompañada de cambios degenerativos en las células ganglionares de la retina y trastornos circulatorios en la coroides. La ambliopía es normalmente bilateral y puede aparecer pocas horas después de la ingestión, mientras que la ceguera total no se instaura hasta pasada una semana. Las pupilas aparecen dila- tadas, la esclerótica congestionada y el iris está pálido y presenta escotoma central; las funciones respiratorias y cardiovasculares están deprimidas y, en los casos muy graves, el paciente está inconsciente, si bien el coma puede ir precedido de delirio.
Las consecuencias de la exposición industrial a los vapores de alcohol metílico pueden variar considerablemente de un traba- jador a otro. Bajo diferentes condiciones de intensidad y duración de la exposición, los síntomas de la intoxicación son: irritación de las mucosas, cefalea, zumbido de oídos, vértigo, insomnio, nistagmo, dilatación de las pupilas, visión borrosa, náuseas, vómitos, cólicos y estreñimiento. Pueden producirse lesiones cutáneas por la acción irritante y disolvente del alcohol metílico y también por la acción lesiva de los tintes y resinas disueltas en él. Estas lesiones se localizan preferentemente en las manos, las muñecas y los antebrazos. No obstante, la causa de estos efectos perjudiciales se debe en general a exposiciones prolongadas a concentraciones muy superiores a los límites recomendados por las autoridades para prevenir la intoxicación por inhalación de vapores de alcohol metílico.
Se ha sugerido que la exposición crónica combinada a metanol y monóxido de carbono es un factor causante de aterosclerosis cerebral.
La acción tóxica del alcohol metílico se atribuye a oxidación metabólica en ácido fórmico o formaldehído, producto éste que tiene un efecto nocivo específico en el sistema nervioso, y posiblemente a acidosis grave. Estos procesos de oxidación pueden ser inhibidos por el alcohol etílico.
Etanol
El alcohol etílico es un líquido inflamable y sus vapores forman mezclas inflamables y explosivas con el aire a temperatura ambiente. Una solución acuosa con un 30 % de alcohol puede producir una mezcla inflamable de vapor y aire a 29 ºC. Otra que contenga solamente un 5 % de alcohol puede producirla a 62 ºC.
La ingestión es poco probable en el entorno industrial, pero posible en el caso de los alcohólicos. El peligro de este consumo anómalo depende de la concentración de etanol, que si es superior al 70 % puede producir lesiones esofágicas y gástricas, y de la presencia de desnaturalizantes. Estos últimos se añaden para hacer que el alcohol tenga un sabor desagradable cuando se obtiene libre de impuestos para fines distintos al del consumo. Muchos de estos desnaturalizantes (p. ej. alcohol metílico, benceno, bases de piridina, metilisobutilcetona, queroseno, acetona, gasolina, dietilftalato, etc.) son más peligrosos para la persona que lo consuma que el propio alcohol etílico. Por todo ello es muy importante asegurarse de que no se produce consumo ilegal de alcohol etílico destinado a usos industriales.
N-propanol
Beneficios de el alcohol
Metanol
- Produce menos contaminación ambiental que los combustibles fósiles.
- Se pueden obtener a partir de materias y residuos renovables tales como pasto, bagazo de caña de azúcar, hojarasca, etc.
- Su utilización no requiere una gran modificación de los vehículos de combustible fósil. Simplemente basta con cambiar las piezas plásticas del circuito de combustible.
Etanol es un combustible a base de alcohol hecho de la fermentación y destilación de almidones como el maíz. También pude producirse de "biomasa celulósica" como árboles y gramíneas. El uso de etanol puede reducir nuestra dependencia en el petróleo extranjero y reducir las emisiones de gases de efecto invernadero.
Nombres y estructuras


Deshidrogenación de los alcoholes.
Bibliográfia de los alcoholes
http://profesionseg.blogspot.com/2007/07/riesgos-para-la-salud-etanol.html
http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedades_alcoholes.htm
http://es.wikipedia.org/wiki/Alcohol
ÉTERES
En química orgánica y bioquímica, un éter es un grupo funcional del tipo R-O-R', en donde R y R' son grupos alquilo, estando el átomo de oxígenounido y se emplean pasos intermedios:ROH + HOR' → ROR' + H2O
Normalmente se emplea el alcóxido, RO-, del alcohol ROH, obtenido al hacer reaccionar al alcohol con una base fuerte. El alcóxido puede reaccionar con algún compuesto R'X, en donde X es un buen grupo saliente, como por ejemplo yoduro o bromuro. R'X también se puede obtener a partir de un alcohol R'OH.RO- + R'X → ROR' + X-
Al igual que los ésteres, no forman puentes de hidrógeno. Presentan una alta hidrofobicidad, y no tienden a ser hidrolizados. Los éteres suelen ser utilizados como disolventes orgánicos.
Suelen ser bastante estables, no reaccionan fácilmente, y es difícil que se rompa el enlace carbono-oxígeno. Normalmente se emplea, para romperlo, un ácido fuerte como el ácido yodhídrico, calentando, obteniéndose dos halogenuros, o un alcohol y un halogenuro. Una excepción son los oxiranos (o epóxidos), en donde el éter forma parte de un ciclo de tres átomos, muy tensionado, por lo que reacciona fácilmente de distintas formas.
Propiedades físicas

La importante solubilidad en agua se explica por los puentes de hidrógeno que se establecen entre los hidrógenos del agua y el oxígeno del éter.

.jpg&container=blogger&gadget=a&rewriteMime=image%2F*)
La estructura angular de los éteres se explica bien asumiendo una hibridación sp3 en el oxígeno, que posee dos pares de electrones no compartidos,no puede establecer enlaces de hidrógeno consigo mismo y sus puntos de ebullición y fusión son muchos más bajos que los alcoholes referibles.
Un caso muy especial lo constituyen los epóxidos, que son éteres cíclicos de tres miembros. El anillo contiene mucha tensión, aunque algo menos que en el ciclo propano.
Cuclo propano

Epóxido de etileno

Debido a que el ángulo del enlace C-o-C no es de 180º, los momentos dipolares de los dos enlaces C-O no se anulan; en consecuencia, los éteres presentan un pequeño momento dipolar neto (por ejemplo, 1.18 D para el dietil éter).
PROPIEDADES QUÍMICAS:
Los éteres tienen muy poca reactividad química, debido a la dificultad que presenta la ruptura del enlace C—O. Por ello, se utilizan mucho como disolventes inertes en reacciones orgánicas.
En contacto con el aire sufren una lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles. Estos constituyen un peligro cuando se destila un éter, pues se concentran en el residuo y pueden dar lugar a explosiones. Esto se evita guardando el éter con hilo de sodio o añadiendo una pequeña cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilación.
Los éteres no son reactivos a excepción de los epóxidos. Las reacciones de los epóxidos pasan por la apertura del ciclo. Dicha apertura puede ser catalizada por ácido o apertura mediante nucleófilo.

(Apertura catalizada por ácido) El nucleófilo ataca al carbono más sustituido.

( Apertura por neoclófilo) El neoclófilo ataca al carbono menos sustituido.
Usos industriales de los eteres
- Medio de arrastre para la deshidratacion de alcoholes isopropilicos y etílicos.
- Disolvente de sustacias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides).
- Combustible inicial de motores diésel.
- Fuertes pegamentos.
- Antinflamatorio abdominal para después del parto, solo uso externo.
- Anestésicos.
Beneficios y riesgos de los eteres
Los PBDEs existen en forma de mezclas de compuestos químicos similares. Debido a que sólo se mezclan con los plásticos y espumas en vez de unirse a ellos, pueden escapar de los productos que los contienen y entrar al medio ambiente.
¿Qué les sucede a los PBDEs cuando entran al medio ambiente?
•Los PBDEs entran al aire, al agua y al suelo durante su manufactura y uso en productos de consumo.
•En el aire, los PBDEs pueden encontrarse como partículas que eventualmente se depositan en el suelo o el agua.
•La luz solar puede degradar algunos PBDEs.
•Los PBDEs no se disuelven fácilmente en agua, pero se adhieren a partículas y se depositan en el fondo de ríos o lagos.
•Algunos PBDEs pueden acumularse en peces, aunque generalmente en bajas concentraciones.
Regrese al comienzo de la página.
¿Cómo puede ocurrir la exposición a los PBDEs?
•Las concentraciones de PBDEs en la sangre, leche materna y tejido graso de seres humanos indican que la mayoría de la gente está expuesta a concentraciones bajas de PBDEs.
•Usted puede estar expuesto a los PBDEs a través del consumo de alimentos o inhalación de aire contaminados con PBDEs.
•Los trabajadores que manufacturan PBDEs o productos que contienen PBDEs pueden estar expuestos a niveles más altos que lo normal.
•También puede ocurrir exposición ocupacional en personas que trabajan en espacios cerrados en donde se reparan o reciclan productos que contienen PBDEs.
Regrese al comienzo de la página.
¿Cómo pueden afectar mi salud los PBDEs?
No hay información definitiva acerca de los efectos de los PBDEs sobre la salud de seres humanos. Las ratas y ratones que comieron alimentos con cantidades moderadas de PBDEs durante unos días sufrieron alteraciones de la glándula tiroides. Aquellos que comieron cantidades más pequeñas durante semanas o meses sufrieron alteraciones de la tiroides y el hígado. En estudios en animales se han observado diferencias marcadas entre los efectos de PBDEs con alto contenido de bromo y los con bajo contenido de bromo.
Hay evidencia preliminar que sugiere que concentraciones altas de PBDEs pueden producir alteraciones del comportamiento y afectar el sistema inmunitario de animales.
¿Qué posibilidades hay de que los PBDEs produzcan cáncer?
No sabemos si los PBDEs pueden producir cáncer en seres humanos. Las ratas y ratones que comieron de por vida alimentos con éter de decabromobifenilo (un tipo de PBDE) desarrollaron tumores en el hígado. Basado en esta evidencia, la EPA ha clasificado al éter de decabromobifenilo como posiblemente carcinogénico en seres humanos. La EPA ha determinado que los PBDEs con menos átomos de bromo que el éter de decabromobifenilo no son clasificables en cuanto a carcinogenicidad en seres humanos debido a la falta de estudios de cáncer en seres humanos y en animales.
¿Cómo pueden los PBDEs afectar a los niños?
Los niños generalmente están expuestos a los PBDEs de la misma manera que los adultos, principalmente al comer alimentos contaminados. Debido a que los PBDEs se disuelven fácilmente en la grasa, pueden acumularse en la leche materna y puede ser transferidos a bebés que lactan.La exposición a los PBDEs en el útero y a través de la leche materna ha producido alteraciones de la tiroides y del comportamiento en animales recién nacidos, pero no ha producido defectos de nacimiento. No se sabe si los PBDEs pueden producir defectos de nacimiento en seres humanos.
¿Cómo pueden las familias reducir el riesgo de exposición a los PBDEs?
•A los niños que viven cerca de sitios de desechos peligrosos se les debe aconsejar no jugar en la tierra cerca de estos sitios. También se les debe enseñar a no comer tierra y a lavarse las manos con frecuencia.
•Las personas que están expuestas a los PBDEs en el trabajo deben ducharse y cambiar de ropa cada día antes de volver al hogar. La ropa de trabajo debe guardarse y lavarse en forma separada de la ropa del resto de la familia.
Estructura y nomenclatura
Los éteres son compuestos de fórmula general R-O-R, Ar-O-R o Ar-O-Ar.
Para designar los éteres, por lo general se indican los dos grupos unidos al oxígeno, seguidos de la palabra éter:


Bibliografia
http://es.wikipedia.org/wiki/%C3%89ter_(qu%C3%ADmica)
ESTERES
Los Ésteres son compuestos orgánicos derivados de ácidos orgánicos o inorgánicos oxigenados en los cuales uno o más protones son sustituidos por grupos orgánicos alquilo (simbolizados por R').
Etimológicamente, la palabra "éster" proviene del alemán Essig-Äther (éter de vinagre), como se llamaba antiguamente al acetato de etilo.1
En los ésteres más comunes el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido acético, el éster es denominado como acetato. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado "éster dimetílico del ácido sulfúrico".
En química orgánica y bioquímica los ésteres son un grupo funcional compuesto de un radical orgánico unido al residuo de cualquier ácido oxigenado, orgánico o inorgánico.
Los ésteres más comúnmente encontrados en la naturaleza son las grasas, que son ésteres de glicerina y ácidos grasos (ácido oleico, ácido esteárico, etc.)
Principalmente resultante de la condensación de un ácido carboxílico y un alcohol. El proceso se denomina esterificación:
Un éster cíclico es una lactona.
propiedades físicas de los ésteres
Los ésteres se nombran como si fueran sales alquídicas de los ácidos carboxílicos, debido a la formal similitud de las reacciones de arriba con las de neutralización.
Los ácidos de bajo peso molecular son líquidos, y tienen un punto de ebullición comparable con el de los alcanos para pesos moleculares similares. Su bajo grado de enlazado del hidrógeno los hace bastantes insolubles en agua, pero tienen excelentes propiedades como solventes de los compuestos orgánicos. La principal aplicación de los ésteres de bajo peso molecular es como disolventes y se producen grandes cantidades de acetato de etilo y acetato de metilo para usarse principalmente con este propósito.
Ésteres naturales
Los ésteres constituyen la mas importante clase de productos distribuidos ampliamente en la naturaleza.
.jpg&container=blogger&gadget=a&rewriteMime=image%2F*)
Los ésteres ligeros son líquidos con agradable olor a fruta y muchas de las fragancias distintivas de las frutas y las flores se debe a la mezcla de ésteres en su constitución. De esta forma el acetato isoamílico está presente en las bananas, el butyrato amílico en los albaricoques y el acetato de etilo en las piñas, aunque el verdadero olor de estas frutas depende de una mezcla compleja de ésteres y otras sustancias.
.jpg&container=blogger&gadget=a&rewriteMime=image%2F*)
Las ceras son ésteres de alcoholes de alto peso molecular mono-hídricos con cualquiera de los ácidos grasos pesados de cadena recta. De modo que la cera de abejas, la cera carnauba y otras, son mezclas naturales de dos o mas ésteres.
Las grasas y aceites naturales son ésteres de ácidos grasos de cadena larga con la glicerina. Las grasas derivadas de los ácidos grasos saturados (por ejemplo; la manteca) tienen un alto punto de fusión y por tanto son sólidos a temperatura ambiente. Aquellas derivados de los ácidos grasos mono o poli-insaturados (por ejemplo; el aceite de maní o maíz) tienen bajo punto de fusión y son líquidos a temperatura ambiente. Los aceites líquidos tal como el de algodón, se "endurecen" en la industria por hidrogenación de los dobles enlaces para producir grasas sólidas saturadas. El sustituto de la mantequilla, la oleo margarina no es mas que aceite vegetal parcialmente hidrogenado a la que se le agrega el sabor y color naturales.
Otros aceites no saturados (por ejemplo; el de linaza) se usan en la industria de las pinturas como agente de secado, debido a que su exposición al aire produce una auto oxidación y polimerización que genera un material como laca que produce gruesas capas de protección.
Los aceites comestibles derivados de las grasas no saturadas se enrancian con el tiempo al exponerse al aire, la auto oxidación que se produce genera productos de degradación (aldehídos volátiles, cetonas, y ácidos) que causan la perdida del olor y el sabor.
Esteres
¿Que beneficios y riesgos tienen los esteres para la salud?
Los disolventes y las tintas son los productos químicos que con mas frecuencia se utilizan el Sector de Artes de Gráficas, dado que alguno de estos productos pueden ser sumamente peligrosos para la salud y hasta mortales
cuando se utilizan sin las precauciones adecuadas, el conocimiento previo
de los riesgos que conlleva su utilización, así como un sistema eficaz de
seguridad y salud constituyen la mejor prevención y protección de los trabajadores frente a éstos riesgos.
•Los éteres están comprendidos como una clase de compuestos en los cuales dos grupos del tipo de loshidrocarburos están enlazados a un átomo de oxígeno, es decir su estructura general es del tipoR-O-R. En los éteres simétricos los dos grupos son idénticos mientras que en los asimétricos son diferentes.
NOMENCLATURA:
Se nombran poniendo la palabra oxi entre los dos radicales. Se considera el compuesto como derivado del radical más complejo, así diremos metoxietano, y no etoximetano.
•También podemos nombrar los dos radicales, por orden alfabético, seguidos de la palabra "éter".
Otros son llamados con nombres comunes.
•La nomenclatura IUPAC (International Union of Pure and Applied Chemistry) establece que para llamar a los éteres se comience por numerar el carbono que tiene el grupo alcoxilo (RO-) o el aroxilo (ArO-) , seguido por el nombre correspondiente al alcano formado por la cadena mas larga de carbonos acoplada al oxígeno y utilizando para esta último la misma nomenclatura de los alcanos.
Bibliografia
http://es.wikipedia.org/wiki/%C3%89ster
http://jorge8591.blogspot.com/2013/07/alcoholes-eteres-etere.html
http://damaris-blogquimicaorganica.blogspot.com/2010/07/esteres-estructura-y-nomenclatura.html
Los ésteres alifáticos de cadena recta larga constituyen las grasas, aceites y ceras que aparecen tanto en el reino animal como vegetal.
.jpg&container=blogger&gadget=a&rewriteMime=image%2F*)
Las ceras son ésteres de alcoholes de alto peso molecular mono-hídricos con cualquiera de los ácidos grasos pesados de cadena recta. De modo que la cera de abejas, la cera carnauba y otras, son mezclas naturales de dos o mas ésteres.
Las grasas y aceites naturales son ésteres de ácidos grasos de cadena larga con la glicerina. Las grasas derivadas de los ácidos grasos saturados (por ejemplo; la manteca) tienen un alto punto de fusión y por tanto son sólidos a temperatura ambiente. Aquellas derivados de los ácidos grasos mono o poli-insaturados (por ejemplo; el aceite de maní o maíz) tienen bajo punto de fusión y son líquidos a temperatura ambiente. Los aceites líquidos tal como el de algodón, se "endurecen" en la industria por hidrogenación de los dobles enlaces para producir grasas sólidas saturadas. El sustituto de la mantequilla, la oleo margarina no es mas que aceite vegetal parcialmente hidrogenado a la que se le agrega el sabor y color naturales.
Otros aceites no saturados (por ejemplo; el de linaza) se usan en la industria de las pinturas como agente de secado, debido a que su exposición al aire produce una auto oxidación y polimerización que genera un material como laca que produce gruesas capas de protección.
Los aceites comestibles derivados de las grasas no saturadas se enrancian con el tiempo al exponerse al aire, la auto oxidación que se produce genera productos de degradación (aldehídos volátiles, cetonas, y ácidos) que causan la perdida del olor y el sabor.
Usos de los esteres
los ácidos son:
- metanoico
- acetico
- citrico
- acetilsalicilico
- lactico
- oxalico
- benzoico
Esteres
- metanoato de etilo
- metanoato de isobutilo
- etanoato de pentilo
- etanoato de isopentilo
- etanoato de octilo
- butanoato de etilo
- butanoato de pentilo
¿Que beneficios y riesgos tienen los esteres para la salud?
Los disolventes y las tintas son los productos químicos que con mas frecuencia se utilizan el Sector de Artes de Gráficas, dado que alguno de estos productos pueden ser sumamente peligrosos para la salud y hasta mortales
cuando se utilizan sin las precauciones adecuadas, el conocimiento previo
de los riesgos que conlleva su utilización, así como un sistema eficaz de
seguridad y salud constituyen la mejor prevención y protección de los trabajadores frente a éstos riesgos.
Estructura y nomenclatura
•Los éteres están comprendidos como una clase de compuestos en los cuales dos grupos del tipo de loshidrocarburos están enlazados a un átomo de oxígeno, es decir su estructura general es del tipoR-O-R. En los éteres simétricos los dos grupos son idénticos mientras que en los asimétricos son diferentes.
NOMENCLATURA:
Se nombran poniendo la palabra oxi entre los dos radicales. Se considera el compuesto como derivado del radical más complejo, así diremos metoxietano, y no etoximetano.
•También podemos nombrar los dos radicales, por orden alfabético, seguidos de la palabra "éter".
Otros son llamados con nombres comunes.
•La nomenclatura IUPAC (International Union of Pure and Applied Chemistry) establece que para llamar a los éteres se comience por numerar el carbono que tiene el grupo alcoxilo (RO-) o el aroxilo (ArO-) , seguido por el nombre correspondiente al alcano formado por la cadena mas larga de carbonos acoplada al oxígeno y utilizando para esta último la misma nomenclatura de los alcanos.
Bibliografia
http://es.wikipedia.org/wiki/%C3%89ster
http://jorge8591.blogspot.com/2013/07/alcoholes-eteres-etere.html
http://damaris-blogquimicaorganica.blogspot.com/2010/07/esteres-estructura-y-nomenclatura.html










.jpg)

.jpg)


.jpg)
.gif&container=blogger&gadget=a&rewriteMime=image%2F*)
.jpg)
Trabajo de química
ResponderEliminar